
北京地坛医院建立创新药械临床试验“绿色通道”
为主动践行医疗机构对医学原始创新和产业的支撑能力,充分发挥研究型病房建设的示范带动作用,首都医科大学附属北京地坛医院建立创新药械临床试验“绿色通道”,优化审核步骤,缩短受理周期,全流程提升临床急需创新药械临床试验效率。
适用范围
创新药物I-III期注册临床试验
创新医疗器械注册临床试验
北京市生物医药企业发起的注册临床试验
工作举措
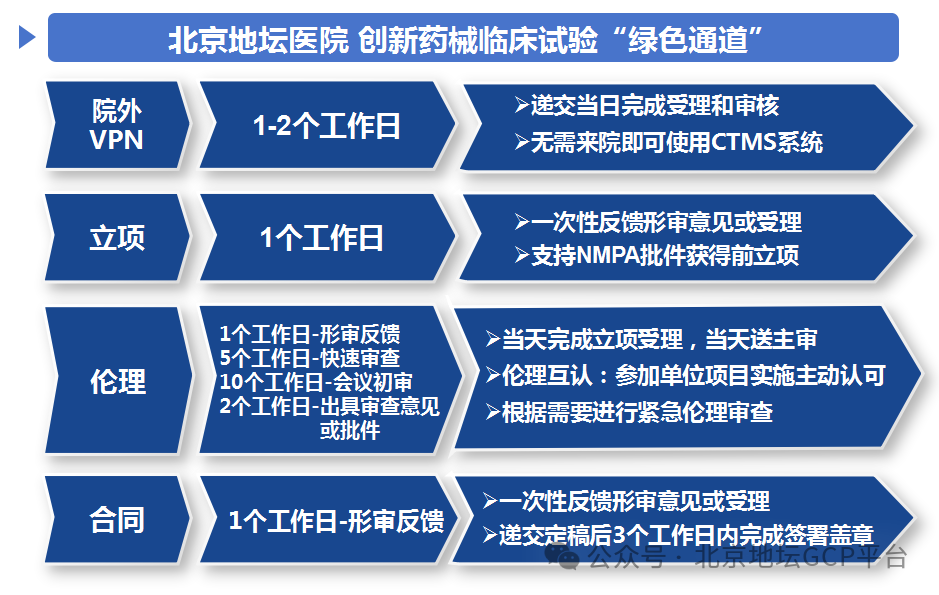
院外VPN申请
机构办公室在递交当日完成受理和审核,信息中心在2个工作日内完成开通。
立项审核
递交立项资料后的1个工作日内,机构办公室一次性反馈形式审查意见或受理。对于未获得国家药品监督管理局药物临床试验通知书的临床试验,支持申办方在向国家药品监督管理局药品审评中心递交临床试验申请时,同步向本机构提交立项资料。
伦理审查
递交立项资料后的1个工作日内,伦理委员会办公室一次性反馈形式审查意见或受理。且当天完成立项受理,当天送主审。
受理后的10个工作日内,伦理委员会完成初次伦理会议审查;可根据临床试验需要申请进行紧急伦理审查。完成伦理审查后的2个工作日内出具伦理审查意见或批件。
对于本机构参研的多中心临床试验,组长单位已完成伦理审查且组长单位符合本机构认定的主审资质的项目,实施主动认可,采取快速审查方式对项目进行审议。快速审查在正式受理后的5个工作日内完成伦理审查,2个工作日内出具伦理审查意见或批件。
符合以下条件之一可评估认定主审资质:
(1)国家临床医学研究中心,或国家医学中心,或牵头完成国家科技重大专项或国家重点研发计划支持项目的医院;
(2)中国医院科技量值(STEM)排行榜的年度排名为全国前100名(含100名,上一年度)医院;
(3)伦理委员会近3年每年至少审查过3个本单位牵头的多中心注册类药物和医疗器械临床试验的医院;
(4)通过世界中医药学会联合会CAP或美国AAHRPP或亚太SIDCER等国内国际认证的三级医院。
合同审核
支持同步进行合同审核与伦理审查。机构提供药物及医疗器械临床试验申办方-机构两方协议模板、申办方-CRO-机构三方协议模板以及临床研究协调员服务协议模板。
对于使用我院合同模板的项目,递交合同初稿的1个工作日内,机构办公室一次性反馈审核意见或批准,财务处在2个工作日内一次性反馈审核意见或批准。接收定稿版合同后的3个工作日内完成签署盖章。
人类遗传资源管理
递交当日受理,在1个工作日内一次性反馈审核意见或受理。接收纸质申请文件的3个工作日内完成签署盖章。
科研账号申请
首笔试验经费支付后,研究者即可申请开通试验项目科研账号。
机构办公室在递交申请表当日完成受理和审核,财务处、门诊办公室、住院处和信息中心在3个工作日内依次完成审核并开通。
试验用药物管理
实行GCP中心药房统一管理。立项之日起即可和药物管理员沟通试验用药物转运和接收事宜,支持通过伦理审查并签署合同后、召开启动会前即可进行试验用药物接收。
我院临床试验机构简介

